研究室紹介
最近私どもは、生理的な抗アルツハイマー病因子であるBRI2とBRI3を選択的にユビキチン化して分解へと導くNRBP1-ユビキチンリガーゼ複合体を発見しました。そこで、新規アルツハイマー病治療薬の開発を目指して、当該ユビキチンリガーゼの基質認識サブユニットNRBP1とBRI2/BRI3間の相互作用を特異的に阻害する化合物の創製に取り組んでいます。
EDUCATION
最近私どもは、生理的な抗アルツハイマー病因子であるBRI2とBRI3を選択的にユビキチン化して分解へと導くNRBP1-ユビキチンリガーゼ複合体を発見しました。そこで、新規アルツハイマー病治療薬の開発を目指して、当該ユビキチンリガーゼの基質認識サブユニットNRBP1とBRI2/BRI3間の相互作用を特異的に阻害する化合物の創製に取り組んでいます。
アルツハイマー病(AD)は認知症の約7割を占めるが、根治療法は存在せず、その開発が急務です。アミロイド前駆体(APP)結合タンパク質であるBRI2とBRI3は、ADの主要病因物質であるアミロイドβ(Aβ)の産生、分解、凝集、および糖尿病の発症と同病へのAD合併に深く関わる膵島アミロイドポリペプチド(IAPP; 別名アミリン)の分解、凝集、の複数の過程を制御することにより生理的な抗AD因子として機能します(図1の❶〜❺)。
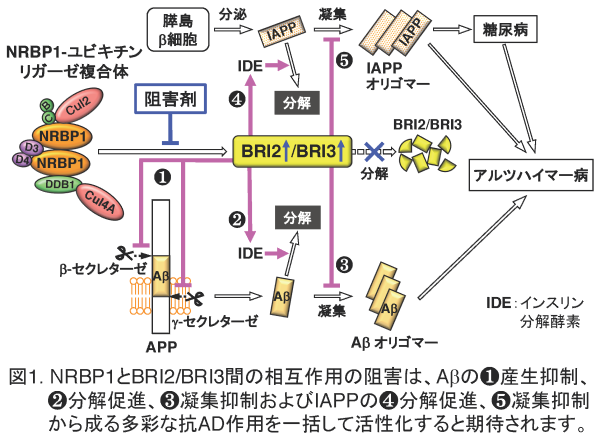
また、BRI2遺伝子の片方のアレルの変異は、正常BRI2タンパク質量の減少によるAβ産生の亢進を招き、AD類似の臨床症状と神経病理学的所見を示す家族性の英国型認知症(FBD)やデンマーク型認知症(FDD)の発症原因になります。さらに、AD発症初期患者の海馬においてもAPPと結合しているBRI2タンパク質の減少が認められることから、ADの発症にもBRI2の抗AD機能の低下が関与している可能性が示唆されています。
最近私どもは、機能未知であったNRBP1が基質認識サブユニットとして二量体化し、Cul2およびCul4Aと結合してヘテロ二量体構造のNRBP1-ユビキチンリガーゼ複合体を形成、BRI2とBRI3を選択的にユビキチン(Ub)化してプロテアソームによる分解へと導くことを発見しました。さらに、神経系細胞におけるNRBP1の機能阻害が、細胞内BRI2/BRI3タンパク質の増加と共にAβ産生量の有意な減少を誘導することを明らかにしました(Cell Rep. 2020)。
NRBP1とBRI2/BRI3間の相互作用を特異的に阻害する化合物(BRI2/3-Ub化阻害剤)は、生理的因子であるBRI2/BRI3の細胞内在量を増加させ、多彩な抗AD作用を一括して活性化すると想定されるため、副作用発現のリスクが低く、β-セクレターゼ阻害剤やアデュカヌマブと比べて優位性があると期待されます(図1, 表1)。そこで現在、ADに対する根本治療薬の開発を目指して、理化学研究所の創薬・医療技術基盤プログラムの支援のもと、当該阻害剤の創製に取り組んでいます。

1) 新規アルツハイマー病治療薬開発を指向したBRI2/3-ユビキチン化阻害剤の創製
2) NRBP1の機能喪失がアルツハイマー病の病態に及ぼす影響の解析
