 |
|
「嗅覚コミュニケーション・個体認識記憶機構の解明」
椛 秀人 (医療学系基礎医学部門生理学講座 教授)
研究の概要:
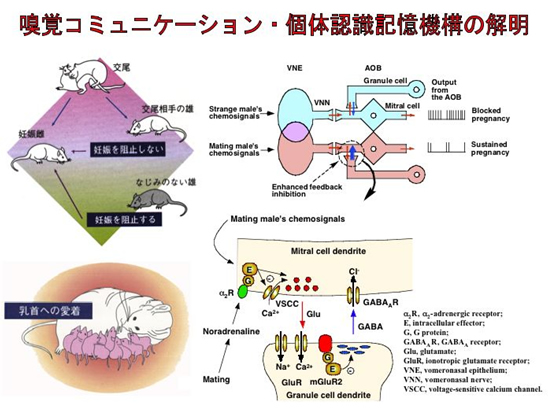
ヒトが主として視覚や聴覚で情報を得ているのに対し、多くの動物は化学物質を主要な手掛かりにして世界を知る。これらの化学物質の中には、同じ動物種の仲間同士が情報交換に用いるフェロモンが含まれ、動物が社会生活を営む上で欠かせないものとなっている。多くの哺乳動物は、2つの主要な匂い情報処理系を有している。一方は主嗅覚系(単に嗅覚系とも呼ぶ)、他方は鋤鼻(副嗅覚)系と呼ばれている。両系とも感覚受容細胞に発現している7回膜貫通型のGタンパク質共役型受容体が匂いやフェロモンを受容する。主嗅覚系は、揮発性の匂い分子を感度よく感知し、構造的に関連した匂い分子間のコントラストを強調してこれらを識別する。一方、鋤鼻系は、性、生殖状態、系統、幼若か成体か、社会的順位などを特徴づけるフェロモン情報の処理を行い、ひいては内分泌反応や生得的行動を惹起する。これらの匂いやフェロモンが発達、交尾、分娩といった生涯の特定の時期(感受性期)に刷り込まれると、その後の匂い・フェロモンに対する個体応答が適応的なものに変化する。われわれはこれまでに、①交尾を契機に雌マウスに形成される交配雄のフェロモンの記憶、②新生仔ラットにおける匂い学習、③ラットにおける母性行動の何れにおいても嗅球(主嗅球あるいは副嗅球)が学習や記憶に中心的な役割を果たす脳部位であることを示し、さらに神経・シナプス・分子レベルでのメカニズムを解明してきた。また、鋤鼻器と副嗅球の共培養による鋤鼻系のin vitro再構成系を確立し、鋤鼻ニューロンの分化・成熟や鋤鼻系の神経回路形成のメカニズムを明らかにしてきた。本研究では、これまでの成果を基盤として、嗅覚コミュニケーション・個体認識記憶機構における膜受容体の役割を明らかにする。
椛 秀人(かば ひでと)
学歴
昭和 49年 3月 鹿児島大学農学部獣医学科卒業(獣医師免許取得)
55年 3月 徳島大学大学院栄養学研究科博士課程単位修得退学
(57年9月修了、保健学博士)
職歴
昭和 55年 4月 高知医科大学医学部 助手
60年 3月 ケンブリッジ大学解剖学科へ留学(61年7月まで)
63年 4月 高知医科大学医学部 助教授
平成 7年 4月 鹿児島大学農学部 教授
9年12月 高知医科大学(15年10月より高知大学)医学部 教授
15年 1月 Chemical Senses誌のExecutive Editor(平成20年12月まで)
15年11月 岡崎国立共同研究機構(平成16年4月より自然科学研究機構)
生理学研究所環境適応機能発達研究部門(客員部門)教授
(平成21年3月まで)
21年 4月 日本味と匂学会 会長
現在に至る
代表論文
1) Olfactory recognition: a simple memory system.
Brennan P, Kaba H, Keverne EB.
Science. 1990 Nov 30;250(4985):1223-6.
2) Induction of an olfactory memory by the activation of a metabotropic glutamate receptor.
Kaba H, Hayashi Y, Higuchi T, Nakanishi S.
Science. 1994 Jul 8;265(5169):262-4.
3) Olfactory imprinting in mammals.
Kaba H
In: Comparative Social Cognition, Watanabe S, Tsujii T, Keenan JP (eds), Keio University Press, 2007, pp 79-101.
|
|
|
「ファージレセプター分子の特定と機能解明」
松崎 茂展(医療学系基礎医学部門微生物学講座 准教授)
研究の概要
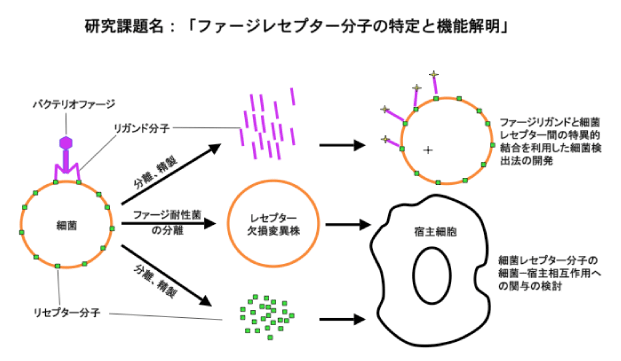
バクテリオファージ(ファージ)は、細菌への感染の最初期に、尾部先端部に存在するリガンド分子(繊維状タンパク質)と細菌表層に存在するレセプター分子(タンパク質、糖鎖等)との間の極めて特異性の高い結合を介して、菌体表層に吸着する。本研究では、ファージが有する細菌への特異的吸着能を利用して、新規細菌検出法の開発、および細菌の動物感染における細菌表層分子(レセプター分子)の役割の解明を目指す。
(1)ファージリガンド分子の特定および精製:ファージゲノムのアノテーションにより、リガンド分子の遺伝子を推定する。当該遺伝子産物を大腸菌内で大量発現させ、精製する。精製タンパク質分子を標的細菌に作用させ、蛍光、発色、菌凝集反応等を利用して当該分子と細菌の結合を確認し、ファージリガンドであることを確認する。同時に他菌種への低結合性を確認する。その後、リガンド分子と細菌の最適な結合条件、検出条件を検討し、ファージリガンド分子を使用する新規細菌検出法の開発を目指す。
(2)細菌側セプター分子の特定および精製:宿主菌を親株としてファージ非感受性変異株を分離する。それらの中で、吸着能欠損によりファージ非感受性となっている変異株について、外膜タンパク質、脂質、糖鎖等の組成を親株と比較し、レセプター分子を推定する。推定レセプター分子を精製し、これをファージ?細菌の吸着実験系に添加し、競合的吸着阻害効果の検討により、レセプター分子であることの確認を行なう。
一方、吸着変異株の分離が困難な場合は、直接菌体表層の構成分を分画、精製し、ファージ吸着に関する競合的阻害実験によりレセプター分子の特定を行なう。
(3)レセプター分子の細菌-宿主(動物)細胞間相互作用への関与の検討:上記ファージ非感受性変異株と親株を宿主細胞培養系に添加し、細胞変性効果等の検討により、レセプター分子の細菌?宿主細胞間相互作用への関与を検討する。また精製レセプター分子を直接動物培養細胞系に添加し、レセプター分子自体の宿主細胞への影響を検討する。レセプター分子について、細菌-宿主相互作用への影響が予想された場合、レセプター欠損変異株あるいはレセプター分子をマウスに接種し、細菌感染におけるレセプター分子(細菌表層分子)の役割を検討する。
松崎 茂展(まつざき しげのぶ)
学歴・職歴
1977年3月 山口大学文理学部理学科生物学専攻 卒業
1985年3月 広島大学大学院理学研究科博士後期課程 単位取得退学
1986年3月 工学博士 (広島大学)
1986年4月 高知医科大学 文部教官助手
1996年7月-1997年4月 文部省在外研究員
(米国マサチューセッツ州ハーバード大学医学部細胞生物学教室)
2003年1月 博士(医学) (旧高知医科大学)
2003年4月 高知医科大学 文部教官 助教授
2003年10月 高知大学医学部 助教授
2007年4月 高知大学医学部 准教授
代表論文
1) In silico and in vivo evaluation of bacteriophage φEF24C, a candidate for treatment of Enterococcus faecalis infections. Uchiyama J, Rashel M, Takemura I, Wakiguchi H, Matsuzaki S. Appl Environ Microbiol. 2008 Jul;74(13):4149-63. Epub 2008 May 2.
2) Efficient elimination of multidrug-resistant Staphylococcus aureus by cloned lysin derived from bacteriophage φMR11. Rashel M, Uchiyama J, Ujihara T, Uehara Y, Kuramoto S, Sugihara S, Yagyu K, Muraoka A, Sugai M, Hiramatsu K, Honke K, Matsuzaki S. J Infect Dis. 2007 Oct 15;196(8):1237-47. Epub 2007 Sep 11.
3) Experimental protection of mice against lethal Staphylococcus aureus infection by novel bacteriophage φMR11. Matsuzaki S, Yasuda M, Nishikawa H, Kuroda M, Ujihara T, Shuin T, Shen Y, Jin Z, Fujimoto S, Nasimuzzaman MD, Wakiguchi H, Sugihara S, Sugiura T, Koda S, Muraoka A, Imai S. J Infect Dis. 2003 Feb 15;187(4):613-24. Epub 2003 Feb 7.
|
|
|
「大脳腹側部における神経軸索ガイダンス分子の探索と機能解明」
平野 伸二 (医療学系基礎医学部門解剖学講座 准教授)
研究の概要
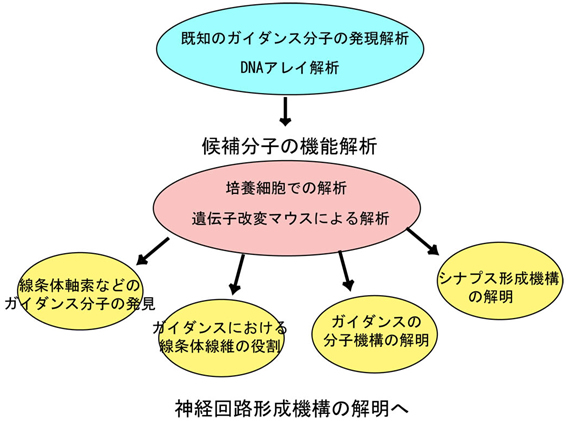
大脳腹側部には皮質視床路、皮質脊髄路、視床皮質路、線条体黒質経路などいくつもの主要な神経回路が存在し、これらの神経回路は大脳の神経活動には非常に重要な役割を果たしている。これらの神経回路形成にはガイドポスト細胞と呼ばれる特殊な細胞や転写因子Pax6や分泌タンパクslit-1など様々な分子が関与していることがこれまでの研究から報告されている。私はこれまでにOLプロトカドヘリンという細胞接着分子を発見し、この分子が線条体線維の伸長に関与し、この伸長過程がその後の皮質脊髄路や視床皮質路などの神経回路形成に重要なはたらきをしていることを示した。このように大脳腹側部の神経回路形成機構の研究は進んできたが、まだ十分な解明には至っていない。例えば、線条体線維が淡蒼球を通過し収束していく機構や視床皮質線維が大脳皮質に向かって伸長していく機構などわからないことは数多い。
この領域における神経回路形成の分子機構を明らかにするために、本研究では神経軸索の細胞膜上に存在するガイダンス分子の探索とそれらの機能解明を行っていく。マウス脳においてこの領域に発現しているガイダンス分子を見つけ、それらの分子の機能を培養系や変異マウスを用いて解析を行う。特に反発作用のあるセマフォリン/プレキシンや細胞接着であるプロトカドヘリンなどについて調べ、未知の神経ガイダンス機構を明らかにしていく。
平野 伸二(ひらの しんじ)
学歴・職歴
1987年 京都大学理学部卒。
1992年 京都大学大学院博士課程修了。理学博士。
岡崎国立共同研究機構基礎生物学研究所助手、南カリフォルニア大学ドウヒーニー眼研究所博士研究員、ヒューマンフロンティアサイエンスプログラム長期フェロー、愛知県心身障害者コロニー発達障害研究所研究員、科学技術振興機構 さきがけ研究21研究員、理化学研究所発生再生総合科学研究センター研究員などを経て2008年より現職。
代表論文
1) Pioneers in the ventral telencephalon: The role of OL-protocadherin-dependent striatal axon growth in neural circuit formation.
Hirano S.
Cell Adh Migr. 2007 Oct;1(4):176-8.
2) OL-Protocadherin is essential for growth of striatal axons and thalamocortical projections.
Uemura M, Nakao S, Suzuki ST, Takeichi M, Hirano S.
Nat Neurosci. 2007 Sep;10(9):1151-9.
3) Expression of a novel protocadherin, OL-protocadherin, in a subset of functional systems of the developing mouse brain.
Hirano S, Yan Q, Suzuki ST.
J Neurosci. 1999 Feb 1;19(3):995-1005.
|
|
|
「セレクチンリガンドをもつKL-6/MUC1分子の発現機構の解明」
横山 彰仁(医療学系臨床医学部門血液・呼吸器内科学講座 教授)
研究の概要
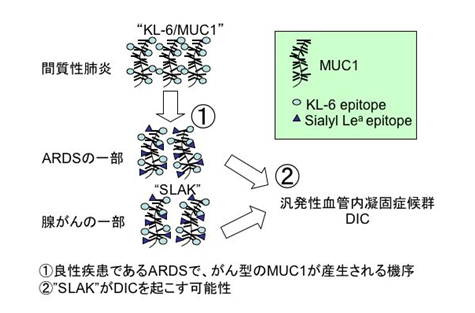
これまでに我々は間質性肺炎の血清マーカーとして用いられているKL-6の研究開発に携わってきた。現在、KL-6は年間100万回以上測定されており、血清マーカーとしての地位が確立されている。KL-6は膜貫通型糖タンパクであるMUC1分子上に発現される糖鎖であり、KL-6の構造は未だ明らかではないが、肺胞2型上皮を主な産生源とし、多くの間質性肺炎で上昇する。最近、KL-6が急性肺損傷/急性呼吸促迫症候群(ALI/ARDS)においても上昇することが明白になっている。我々の検討では、ALI/ARDSにしばしば合併し、かつ死因となる汎発性血管内凝固症候群(DIC)の発生とKL-6の値が関係することを明らかにしている。
セレクチンは種々の細胞表面に発現し、そのリガンド間で免疫あるいは炎症細胞間の相互作用に関与している。抗セレクチン治療が実験的なALI/ARDSモデルにおいて有効であることが報告されている。最近、我々は一部の癌細胞のKL-6/MUC1分子上にセレクチンリガンドが発現しており、例えばシアリルルイスa分子に対する抗体とKL-6抗体でサンドイッチして測定可能な分子(“SLAK”と命名)を血中で測定し、濃度が高値であると、転移が促進され、独立した肺腺癌の予後不良因子となることを明らかにした。SLAKは良性疾患でも上昇することがあり、特に急性呼吸促迫症候群(ARDS)では高値になりやすい。ところが、同じくKL-6が著しく上昇する急性型過敏性肺炎では、SLAKは上昇しない。この理由は現時点では不明である。
近年の報告では、癌性ムチンとセレクチンの相互作用が、がんで認められるTrousseau症候群の原因と深く関わっていることが示されている。セレクチンリガンドを含めた種々の糖鎖が癌性ムチンに発現し、免疫あるいは細胞間反応、細胞間接着に関与することが知られている。癌性ムチンの静脈投与により、組織因子やエンドトキシンの関与無しに、血管内の血小板豊富な血栓の生成を引き起こすことが明らかにされている。
本研究では、セレクチンリガンドをもつKL-6/MUC1が、良性疾患であるARDSにおける汎発性血管内凝固症候群(DIC)と関連するかどうかを明確にする。また、それが明確になれば、特に癌細胞におけるセレクチンリガンドをもつKL-6/MUC1特にSLAKの発現機構を解明し、ARDSなど一部の良性疾患でも発現する機序を明らかにし、重篤な合併症であるDICを予防することにつなげたいと考えている。
横山 彰仁(よこやま あきひと)
略歴
昭和 58 ( 1983 ) 年 富山医科薬科大学 医学部医学科卒業
昭和 61 ( 1986 ) 年 米国シカゴ大学 免疫学 Research Fellow(2年間)
平成 3 ( 1991 ) 年 愛媛大学医学部(第二内科) 助手
平成 12 ( 2000 ) 年 同 講師
平成 15 ( 2003 ) 年 広島大学大学院分子内科学(旧第二内科) 講師
平成 17 ( 2005 ) 年 同 助教授
平成 19 ( 2007 ) 年 高知大学医学部 教授 (血液・呼吸器内科学、旧第三内科)
現在に至る
代表論文
1) Circulating KL-6/MUC1 as an independent predictor for disseminated intravascular coagulation in acute respiratory distress syndrome. Nakashima T, Yokoyama A, Ohnishi1 H, Hamada H, Ishikawa N, Haruta Y, Hattori N, Tanigawa K, Kohno N.
J Intern Med, 2008;263:432-9
2) Suppressor of cytokine signaling1 inhibits pulmonary inflammation and fibrosis. Nakashima T, Yokoyama A, Ohnari Y, Syoda H, Haruta Y, Hattori N, Naka T, Kohno N.
J Allergy Clin Immunol, 2008;121:1269-76.
3) Airflow Limitation in Smokers is Associated with Subclinical Atherosclerosis. Iwamoto H, Yokoyama A, Kitahara Y, Ishikawa N, Haruta Y, Yamane K, Hattori N, Hara H, Kohno N.
Am J Respir Crit Care Med. 2009;179:35-40
|
|
|
「脳内細胞膜リン脂質が交感神経-副腎髄質系賦活の中枢性制御に果たす役割の解明」
清水 孝洋(医療学系基礎医学部門薬理学講座 准教授)
研究の概要
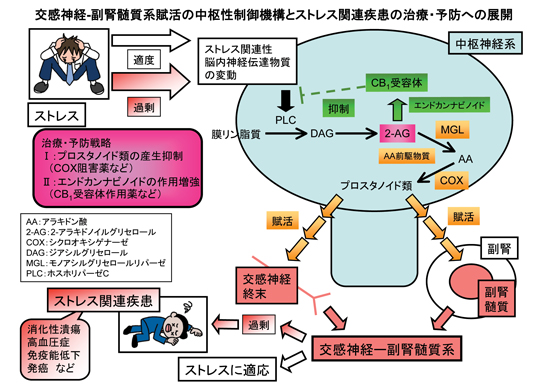
細胞膜は、自身に組み込まれた種々のタンパク質[受容体、GTP結合タンパク質、ホスホリパーゼ C(PLC)など]を介して細胞外情報を細胞内に伝達する場として機能するのみならず、細胞膜構成成分が情報伝達物質の原材料となるなど、生命活動に重要な役割を担っています。
私達は、細胞膜リン脂質由来の情報伝達物質であるプロスタノイド類に着目して、ストレスに対する生体反応機構を、ストレス反応に重要な役割を担う交感神経-副腎髄質系(SA系)との関連で研究してきました。その結果、脳内プロスタノイド類がSA系の賦活に関与することを明らかにしました(Shimizu et al., Eur J Pharmacol 2006;541:152-7; Lu et al., Eur J Pharmacol 2008;590:177-84; Sasaki et al., Eur J Pharmacol 2008;592:81-6; Shimizu and Yokotani, Eur J Pharmacol 2009;606:77-83; Eur J Pharmacol 2009;611:30-4)。
そこで、SA系賦活反応に関わるプロスタノイド類の脳内産生機構を解析した所、興味深いことに、従来から知られているホスホリパーゼA2を介した産生機構ではなく、PLCを介した産生機構であることがわかりました。すなわち、①脳内PLC/ジアシルグリセロールリパーゼを介して産生された2-アラキドノイルグリセロール(2-AG)が脳内プロスタノイド類の産生源として、本賦活反応の促進に関与することを明らかにしました(Shimizu et al., Eur J Pharmacol 2004;499:99-105; Eur J Pharmacol 2005;514:151-8; Eur J Pharmacol 2007;571:138-44; Eur J Pharmacol 2010;641:54-60; Eur J Pharmacol 2011;658:123-31; Eur J Pharmacol 2012;691:93-102; Shimizu and Yokotani, Eur J Pharmacol 2008;582:62-9)。加えて、②この2-AGは強力な脳内大麻(エンドカンナビノイド: eCB)として、脳内カンナビノイドCB1受容体(いわゆる大麻受容体)を介し、本賦活反応を抑制性にも制御することを明らかにしました(Shimizu and Yokotani, Eur J Pharmacol 2008;582:62-9; Shimizu et al., Eur J Pharmacol 2010;641:54-60; Eur J Pharmacol 2011;658:123-31)。以上から、2-AGがSA系賦活に対して①および②の役割、すなわち、二方向性の役割を有するユニークな分子として脳内で機能していることがわかりました(Shimizu et al., J Pharmacol Sci 2013;121:157-71)。
本研究では、SA系賦活の中枢性制御機構を、脳内細胞膜リン脂質由来の生理活性物質(特にプロスタノイド類およびeCB)およびその受容体との関連で明らかにすることを目的としています。ストレス反応に重要な役割を担うSA系の過剰・異常な賦活は、高血圧症などのストレス関連疾患を惹起しますが、これら疾患を根治するためには、SA系賦活制御を担う、中枢神経系を標的とした治療戦略を考える必要があります。本研究の成果は、生体のストレス適応機構解明ならびにストレス関連疾患に対する根本的な治療法開発の足がかりになることが期待されます。
清水 孝洋(しみず たかひろ)
学歴
| 2001年 |
3月 |
北海道大学薬学部総合薬学科卒業 |
| 2001年 |
4月 |
北海道大学大学院薬学研究科修士課程入学 |
| 2003年 |
3月 |
同 修了 |
| 2004年 |
4月 |
高知大学大学院医学系研究科神経科学系専攻博士課程(社会人特別選抜)入学 |
| 2008年 |
3月 |
同 修了 |
職歴
2003年 |
4月 |
高知医科大学(神経薬理学教室)助手 |
2003年 |
10月 |
高知大学医学部(神経薬理学教室)助手 |
2004年 |
4月 |
国立大学法人高知大学医学部(神経薬理学講座)助手 |
2007年 |
4月 |
国立大学法人高知大学医学部(薬理学講座)助教 |
2009年 |
4月 |
高知大学医学部・学内講師 |
2010年 |
4月 |
国立大学法人高知大学教育研究部医療学系基礎医学部門(薬理学講座)助教 |
2011年 |
10月 |
国立大学法人高知大学教育研究部医療学系基礎医学部門(薬理学講座)講師 |
2012年 |
12月 |
国立大学法人高知大学教育研究部医療学系基礎医学部門(薬理学講座)准教授 |
受賞
2012年 3月 第85回日本薬理学会年会優秀発表賞
代表論文
1) Tanaka K, Shimizu T, Yanagita T, Nemoto T, Nakamura K, Taniuchi K, Dimitriadis F, Yokotani K, Saito M. Brain RVD-haemopressin, a haemoglobin-derived peptide, inhibits bombesin-induced central activation of adrenomedullary outflow in the rat. Br J Pharmacol, 171, 202-213, 2014
2) Shimizu T, Tanaka K, Yokotani K. Stimulatory and inhibitory roles of brain 2-arachidonoylglycerol in bombesin-induced central activation of adrenomedullary outflow in rats. J Pharmacol Sci, 121, 157-171, 2013
3) Shimizu T, Tanaka K, Nakamura K, Taniuchi K, Yokotani K. Brain phospholipase C, diacylglycerol lipase and monoacylglycerol lipase are involved in (±)-epibatidine-induced activation of central adrenomedullary outflow in rats. Eur J Pharmacol, 691, 93-102, 2012
4) Shimizu T, Yokotani K. Bidirectional roles of the brain 2-arachidonoyl-sn-glycerol in the centrally administered vasopressin-induced adrenomedullary outflow in rats. Eur J Pharmacol, 582, 62-69, 2008
5) Shimizu T, Uehara T, Nomura Y. Possible involvement of pyruvate kinase in acquisition of tolerance to hypoxic stress in glial cells. J Neurochem, 91, 167-175, 2004
|
|
|
「糖脂質ラフトを場としたT細胞の抗原認識機構」
宇高 恵子(医療学系基礎医学部門免疫学講座 教授)
研究の概要
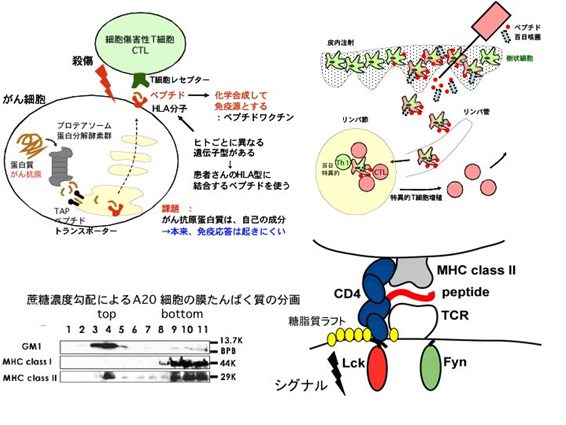
T細胞は、自己の膜蛋白質であるMHC (Major Histocompatibility Complex)分子に、自己、非自己由来のペプチドが結合した複合体を見分けて、それぞれ、自己寛容あるいは攻撃という対照的な応答を起こします。このMHC-ペプチドの見分けの分子機構は明らかになっていません。私たちは、この見分けが、T細胞レセプター(TCR)に対する1分子レベルでの結合親和性においては、たかだか数倍程度の些細な違いにすぎないことを観察しました。このわずかな結合親和性の違いが、異なる膜受容体分子群の応答の違いを生む理由を探りたいと考えています。
TCRによる異物認識応答は、細胞膜上の糖脂質マイクロドメイン(ラフト)を場として起こります。そこで、糖脂質合成酵素のKOマウスを用いてラフトの物性を変化させ、抗原認識に影響が出るか、調べています。一方、ラフトの物性に影響を与える可能性のある脂質を変化させ、T細胞の応答を調べています。
また、ラフトを場とする反応のうち、生体の不用になった細胞の新陳代謝の視点から、子宮内膜の月経周期にともなう脱落・再生のメカニズムを探り、これまで原因が明らかになっていない子宮内膜症の病態生理について理解を深めたいと考えています。
上記の基礎研究が進めば、特定の抗原に対するアレルギーや自己免疫疾患に対し、特定の抗原に対する免疫応答のみを抑え、病原微生物に対する免疫応答は正常に保つ技術の開発につなげることができるかもしれません。一方、私たちがこれまでの研究で身につけた、MHC-ペプチド結合特性の解析や、T細胞の解析技術を活用して、ラフトという反応場をうまく利用した、がんや難治性ウイルスに対するペプチド免疫療法の開発をしています。
宇高 恵子 (うだか けいこ)
学歴
1982年 愛媛大学医学部医学科卒業
1986年 愛媛大学大学院医学系研究科修了
職歴
1985 - 88年 ペンシルバニア大学医学部細菌学 博士研究員
1988 - 91年 マサチューセッツ工科大学ガン研究所 博士研究員
1991 - 93年 マックスプランク生物学研究所チュービンゲン 免疫遺伝学
フンボルト財団奨学研究員
1994 - 94年 順天堂大学医学部免疫学無給助手
1994 - 99年 京都大学理学部生物物理学助手
1999 - 02年 同 助教授
2003 - 03年 高知医科大学医学部免疫学教授
2003 - 高知大学医学部免疫学教授
代表論文
1) A naturally occurring peptide recognized by alloreactive CD8+ cytotoxic T lymphocytes in association with a class I MHC protein.
Keiko Udaka, Theodore J. Tsomides,? Herman N. Eisen.
Cell 1992 69: 989-998
2) Empirical evaluation of a dynamic experiment design method for prediction of MHC class I-binding peptides.
Keiko Udaka, Hiroshi Mamitsuka, Yukinobu Nakaseko and Naoki Abe.
|
|
|
「細胞膜マイクロドメインにおける分子間ネットワークの解明」
本家 孝一 (医療学系基礎医学部門生化学講座 教授)
研究概要
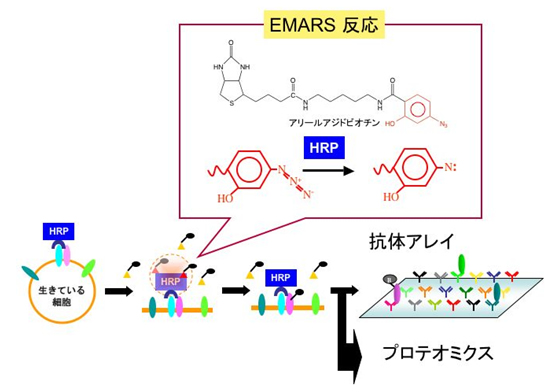
情報伝達、細胞接着、タンパク輸送のような細胞膜が関与する重要な生命現象は、膜マイクロドメインを介することが知られています。しかしながら、そのような膜マイクロドメインが生理条件下でどのように形成されるかを調べることは困難です。私達は、生きている細胞の細胞表面に存在する任意の分子のパートナーを見つけるための新しい方法を開発しました。この方法は、 Enzyme-Mediated Activation of Radical Source (EMARS)と命名しましたが、架橋剤のアリールアジドビオチンを西洋わさびペルオキシダーゼ(HRP)で活性化する点が特徴です。HeLa S3細胞では、多くの種類の受容体チロシンチロシンキナーゼがb1インテグリンと会合しているが、脂質ラフトのマーカーとしてよく使われるガングリオシドGM1は数少ない受容体チロシンチロシンキナーゼとのみ会合していることを見出しました。このように、EMARS法は、生理的条件下で起こる細胞表面分子間相互作用を生化学的に同定する網羅的なアプローチです。
本拠点プロジェクトにおいて、EMARS法と膜マイクロドメイン抗体作製法を基盤技術として、各種病態細胞の細胞膜上分子間ネットワークを解明し、分子間相互作用を標的とする画期的な治療法の開発を目指します。既に、従来法では見つけることのできなかった細胞膜上分子間相互作用を見出しており、その生理的役割を明らかにすることによって、これまで予期されなかった生体システムの制御機構が明らかになる可能性があります。
本家 孝一(ほんけ こういち)
拠点リーダー
学歴
1983 北海道大学医学部卒業
1986 北海道大学大学院医学研究科博士課程中退
職歴
1987-1995 北海道大学医学部附属癌研究施設生化学部門助手・講師
1995-1999 大阪府立母子保健総合医療センター研究所主任研究員
1999-2003 大阪大学大学院医学系研究科生化学・分子生物学講座助教授
2003-present 高知医科大学遺伝子病態制御学教室
(現 高知大学教育研究部医療学系基礎医学部門生化学講座)教授
2008-present 高知大学医学部附属システム糖鎖生物学教育研究センター長
受賞
1997 JB論文賞(日本生化学会)
代表論文
1) Biochemical visualization of cell surface molecular clustering in living cells.
Kotani N, Gu J, Isaji T, Udaka K, Taniguchi N, Honke K.
Proc Natl Acad Sci U S A. 2008 May 27;105(21):7405-9.
2) Dysregulation of TGF-beta1 receptor activation leads to abnormal lung development and emphysema-like phenotype in core fucose-deficient mice.
Wang X, Inoue S, Gu J, Miyoshi E, Noda K, Li W, Mizuno-Horikawa Y, Nakano M, Asahi M, Takahashi M, Uozumi N, Ihara S, Lee SH, Ikeda Y, Yamaguchi Y, Aze Y, Tomiyama Y, Fujii J, Suzuki K, Kondo A, Shapiro SD, Lopez-Otin C, Kuwaki T, Okabe M, Honke K, Taniguchi N.
Proc Natl Acad Sci U S A. 2005 Nov 1;102(44):15791-6
3) Paranodal junction formation and spermatogenesis require sulfoglycolipids.
Honke K, Hirahara Y, Dupree J, Suzuki K, Popko B, Fukushima K, Fukushima J, Nagasawa T, Yoshida N, Wada Y, Taniguchi N.
Proc Natl Acad Sci U S A. 2002 Apr 2;99(7):4227-32.
|
|
|
「腎尿細管細胞の障害と再生過程における細胞内シグナルと生体膜機能の解明」
寺田 典生 (医療学系臨床医学部門内分泌代謝・腎臓内科学講座 教授)
研究の概要:
糸球体腎炎や急性腎不全などの病態を臨床的な見地から問題を提起し、分子生物学的あるいは再生医学など最新の手法を用いて研究を進めてきた。その成果により、日本内科学会奨励賞、日本腎臓学会大島賞、日本透析医学会学会賞などを受賞した。
特に近年、急性腎不全の回復期の尿細管再生のメカニズムの解明を行っており、下記の様な世界に先駆けた研究成果を上げている。Notch-Delta系は細胞極性の保持に重要な働きがある事が神経系の発生等で知られており、尿細管細胞での細胞膜上の分子間ネットワークおよび細胞膜と核内遺伝子発現のシグナル伝達機構の解明は、急性腎不全の病態解明に本質的な意義を持ち、急性腎不全の新規の治療法の解明に直結する研究成果が期待できる。
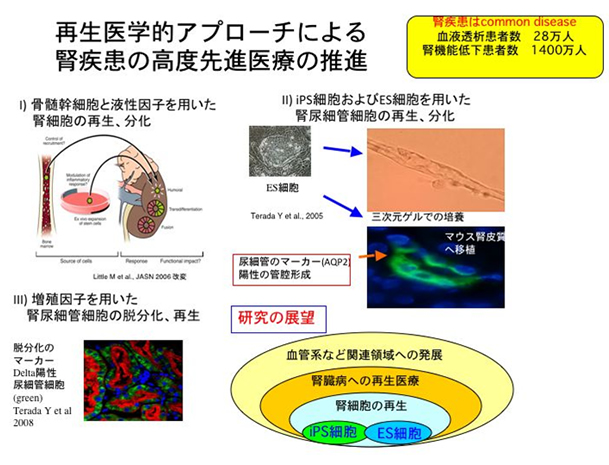
1) 内因性の腎尿細管幹細胞と『dedifferentiation』。
申請者らは、急性腎不全の回復期に腎胎生期に発現する遺伝子、Wnt4およびNotch-Delta系が尿細管細胞に再発現し、胎生期の幹細胞的な性格をもつ、増殖能が高い細胞が近位尿細管に発現することを世界に先駆けて見いだし、尿細管の『dedifferentiation』という概念を提唱した。この『dedifferentiation』という概念はアメリカ腎臓学会誌の総説『急性腎不全の最新のメカニズム』(Devarajan P: Update on Mechanisms of Ischemic Acute Renal Injury, J Am Soc Nephrol, 17, 1503-1530, 2006) にも取り上げられ、認知されている。
2) 腎再生因子(遺伝子)を用いた腎再生研究の発展性
申請者は腎胎生期のKey Moleculeの候補として、Wnt4, Notch2以外にWnt11やSall1に注目している。これらの遺伝子を腎尿細管に遺伝子導入して尿細管細胞が、再生し増殖、修復できる微小環境(Microenviroment)あるいは再生の場(Niche)を作り出す事により、新規の治療法につながる可能性があり、非常に独創的である。
3) iPS細胞(ES細胞)を用いた腎再生研究
iPS細胞(ES細胞)からは、腎細胞への分化の試みは未だない。申請者らは、マウスES細胞をEB(embrioid body)細胞に分化させる際、Wnt-4遺伝子を安定発現するES 細胞を確立し、HGFおよび、Activinを添加すると水チャネル(Aquaporin 2)を発現し、尿細管様構造をとることを報告し、世界で初めてES細胞から腎細胞への分化誘導に成功した。さらに、ヒト間葉系幹細胞をマウス胎児腎内に移植して、腎構成細胞に分化することを米国アカデミー紀要に報告した。
寺田 典生(てらだ よしお)
学歴・職歴
| 1984年 |
3月 |
東京医科歯科大学医学部医学科卒業 |
| 1984年 |
6月 |
東京医科歯科大学第2内科医員 |
| 1988年 |
1月 |
米国国立衛生研究所(NIH)研究員 |
| 1994年 |
11月 |
東京医科歯科大学第2内科助手 |
| 2002年 |
4月 |
東京医科歯科大学大学院 腎臓内科助教授 |
| 2008年 |
4月 |
高知大学医学部内分泌代謝・腎臓内科学講座 教授 |
| 2009年 |
10月 |
高知大学医学部先端医療学推進センター・再生医療部門長(併任) |
| 2010年 |
4月 |
高知大学医学部臨床医学部門・部門長 |
学会活動等
| 1994年 |
4月 |
日本内科学会奨励賞受賞 |
| 1997年 |
10月 |
日本腎臓学会大島賞受賞 |
| 1997年 |
11月 |
日本心血管内分泌代謝学会若手奨励賞受賞 |
| 1999年 |
7月 |
財団法人 成人血管病研究振興財団 岡本研究奨励賞 受賞 |
| 2002年 |
9月 |
国際血液浄化療法学会Best Abstract Award |
| 2003年 |
6月 |
日本透析医学会総会学会賞(木本賞) |
代表論文
1) Terada Y, Tomita K, Nonoguchi H, Yang T, Marumo F: Different localization and r egulation of two types of vasopressin receptor messenger RNA in microdissected rat nephron segments using reverse transcription polymerase chain reaction. J Clin Invest 92: 2339-2345, 1993
2) Terada Y, Tomita K, Homma MK, Nonoguchi H, Yang T, Yamada T, Yuasa Y, Krebs EG, Marumo F: Sequential activation of raf-1 kinase, MAP kinase kinase, MAP kinase, and S6 kinase by hyperosmolality in renal cell. J Biol Chem 269: 31296-31301, 1994
3) Taniguchi K, Kohsaka H, Inoue N, Terada Y, Ito H, Hirokawa K, Miyasaka N: Introduction of p16INK4a sequence gene as a novel therapeutic strategy for the treatment of rheumatoid arthritis. Nature Med 5: 760-767, 1999
|
|
|
「バリア破綻における表皮細胞免疫細胞間クロストークの変調メカニズムの解明」
佐野 栄紀(医療学系臨床医学部門皮膚科学講座 教授)
研究の概要
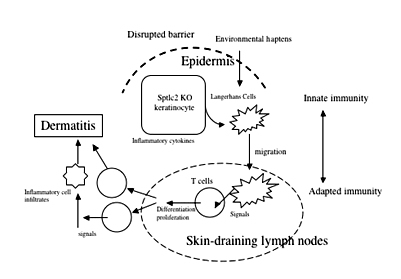
表皮バリアは角層に存在し、ハプテンなどを含む化学物質の滲透を防ぐための機構である。バリアの破綻は掻破、界面活性剤などの機械的・物理的刺激によって引き起こされる。アトピー性皮膚炎(AD)や乾癬など慢性皮膚炎症性疾患でバリアの破綻が認められる。最近、ADの角質では皮膚バリアに必要なセラミドが減少していることも明らかにされた。さらに、フィラグリンの遺伝子変異が高率にアトピー性皮膚炎、気管支喘息でも認められることが報告された。フィラグリンは角層においてバリア機能に重要な蛋白であることより、ADの発症に皮膚バリア破綻が関与していることが一層明らかになってきた。このように、表皮バリア機能の破綻がハプテン抗原の透過を容易にするため、それに対する感作が成立しやすくなる。このように、アレルギーリスクはバリア破綻により増大すると考えられる。しかし、バリア破綻のみが皮膚免疫に直接どのような影響を与えるかについてはいまだ不明である。我々は、セラミド合成酵素の遺伝子(sptlc2)を表皮細胞特異的にノックアウト(cKO)することに成功した。このマウスではバリア修復遅延、表皮細胞の炎症シグナルが発現し、その後皮膚炎を自然に発症することを明らかにした。同時に、皮膚のランゲルハンス細胞の活性化と皮膚および所属リンパ節のTh17細胞の増殖を認めた。この結果は、表皮バリアの破綻シグナルが皮膚固有の免疫系とのクロストークを示唆している。現在、分子レベルでの詳細なメカニズムにつき解析中である。
佐野 栄紀(さの しげとし)
学歴
昭和58年 3月 愛媛大学医学部医学科卒業
昭和63年 3月 大阪大学大学院博士課程(医学)修了
職歴
昭和58年 7月 医員(研修医)(大阪大学医学部附属病院皮膚科)
昭和59年 3月 同 修了
昭和63年 7月 医員(大阪大学医学部附属病院皮膚科)
昭和63年12月 Research fellow(USA, Albert Einstein Medical College免疫微生物学)
平成 4年 4月 市立堺病院皮膚科医長
平成 6年12月 大阪大学医学部皮膚科学講座助手
平成11年 1月 大阪大学大学院医学系研究科講師(皮膚科学講座)
平成15年 6月 Assistant professor(USA, MD Anderson Cancer Center)
平成16年 9月 財団法人住友病院皮膚科部長(平成17年10月まで)
平成17年11月 大阪大学大学院医学研究科講師(皮膚科学)
平成18年 5月 大阪大学大学院医学研究科助教授(皮膚科学)
平成19年 4月 国立大学法人高知大学医学部皮膚科学講座教授
代表論文
1) Impact of Stat3 activation upon skin biology: a dichotomy of its role between homeostasis and diseases. Sano S, Chan KS, DiGiovanni J.
J Dermatol Sci. 2008 Apr;50(1):1-14.
2) Stat3 links activated keratinocytes and immunocytes required for development of psoriasis in a novel transgenic mouse model. Sano S, Chan KS, Carbajal S, Clifford J, Peavey M, Kiguchi K, Itami S, Nickoloff BJ, DiGiovanni J.
Nat Med. 2005 Jan;11(1):43-9.
3) Keratinocyte-specific ablation of Stat3 exhibits impaired skin remodeling, but does not affect skin morphogenesis. Sano S, Itami S, Takeda K, Tarutani M, Yamaguchi Y, Miura H, Yoshikawa K, Akira S, Takeda J. EMBO J. 1999 Sep 1;18(17):4657-68.
|
|
|
「非翻訳RNAによる細胞内シグナル伝達の制御」
坂本 修士 (総合研究センター・分子生物学教室 助教)
研究の概要
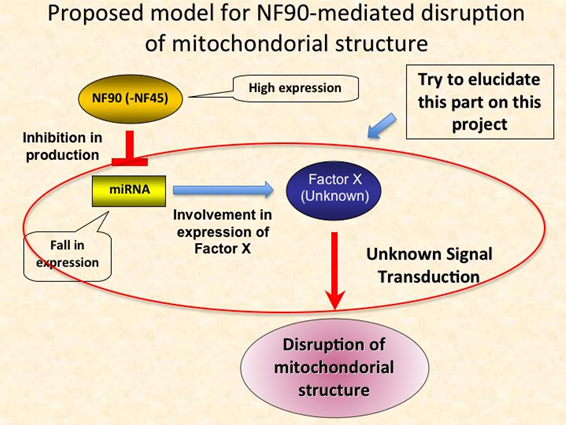
マイクロRNA (miRNA)は非翻訳性の小分子RNAで、真核生物における遺伝子発現の調節因子として機能する。その機能的な重要性は、細胞の増殖、分化、アポトーシスで確認されている。近年、我々は、核内二本鎖RNA結合蛋白質であるNuclear Factor 90 (NF90)とその結合パートナーであるNF45の複合体(NF90-NF45)が、miRNAの生合成経路において負の調節因子として機能することを見出した(MCB 2009 29 (13) 3754-69)。この発見は、これらの蛋白質が、miRNA生合成の調節因子としての機能を通じて、様々な生体制御機構に関与する可能性を示唆している。そこで我々は、このことを検証するために、全身性にNF90-NF45を過剰発現した(Tg)マウスを作出し、表現型を解析することを目指している。それに先立ち、既にNF90及びNF45のTgマウスは作製済みで、現在、両Tgマウスを掛け合わせNF90-NF45 Tgマウスの作出を試みている。同時にNF90及びNF45各々のTgマウスの表現型を解析し、これまでに、NF90 Tgマウスにおいて興味深い現象を見出した。このマウスの最も特徴的な表現型として体の小ささが挙げられる。その要因を探るべく、組織学的解析を進めた結果、NF90が過剰発現している心筋や骨格筋では、ミトコンドリアが脱落し、多くの空胞変性が生じていることがわかった。また生理学的、分子生物学的、形態学的解析により、このマウスは心不全を発症しており、さらに大腿四頭筋、腓腹筋、前脛骨筋等の筋量が顕著に低下していることが明らかとなった。従って、NF90 Tgマウスの体の小ささは、ミトコンドリア変性による筋組織の形成異常によるものであることがわかってきた。そこで現在は、筋組織におけるNF90によるミトコンドリア変性のメカニズムを解明するために、特にNF90によって発現が制御されているmiRNAが関与する細胞内シグナル伝達機構に着目し解析を進めている。
坂本 修士 (さかもと しゅうじ)
学歴
| 1997年4月 |
- |
2001年3月 |
高知医科大学大学院医学研究科・生体制御専攻・博士課程 |
研究歴・職歴
| 1999年1月 |
- |
2001年3月 |
日本学術振興会 特別研究員 (DC) |
| 2001年4月 |
- |
2002年3月 |
日本学術振興会 特別研究員 (PD) |
| 2002年4月 |
- |
2004年9月 |
クリーブランドクリニック ラーナー研究所 ポスドク研究員 |
| 2004年10月 |
- |
2007年3月 |
京都大学大学院医学研究科 先端領域融合医学研究機構 科学技術振興助手 |
| 2007年4月 |
- |
現在 |
高知大学・総合研究センター・生命機能物質部門・機器施設・助教 |
代表論文
1) The NF90-NF45 complex functions as a negative regulator in the microRNA processing pathway.
Sakamoto S, Aoki K, Higuchi T, Todaka H, Morisawa K, Tamaki N, Hatano E, Fukushima A, Taniguchi T, Agata Y.
Mol Cell Biol. 2009 Jul;29(13):3754-69.
2) Histone deacetylase activity is required to recruit RNA polymerase II to the promoters of selected interferon-stimulated early response genes.
Sakamoto S, Potla R, Larner AC.
J Biol Chem. 2004 Sep 24;279(39):40362-7.
3) Cells previously desensitized to type 1 interferons display different mechanisms of activation of stat-dependent gene expression from naive cells.
Sakamoto S, Qin J, Navarro A, Gamero A, Potla R, Yi T, Zhu W, Baker DP, Feldman G, Larner AC.
J Biol Chem. 2004 Jan 30;279(5):3245-53.
|
|
|
「ホヤの神経管形成を制御する細胞内外のシグナル交換メカニズムの解明」
藤原 滋樹(自然科学系理学部門 教授)
研究の概要
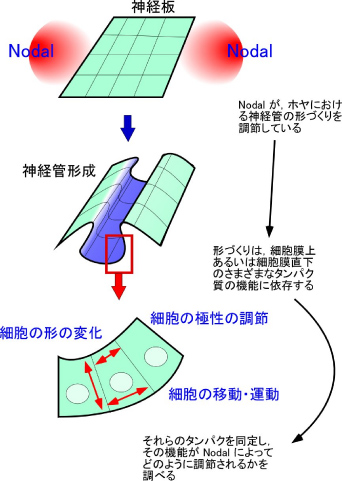
ホヤの幼生は細胞数わずか2500個でありながら,脊索動物の基本的な体制を備えている。そのため,脊索動物の体制を構築する仕組みとその進化を研究するためのモデル動物として重要である。本研究は,脊索動物特有の器官として,背側に生じる神経管に注目し,神経管形成を制御する細胞増殖因子や細胞外マトリックスなどの細胞外因子と,転写調節因子などの細胞内因子との相互作用の仕組みの解明を目指す。
私たちは,これまでに細胞増殖因子Nodalが,転写因子Cdxの機能を介して神経管形成に関与することを明らかにした。また,マイクロアレイ解析によってNodalの標的遺伝子を多数同定した。その中には,細胞外マトリックス分子や細胞接着分子,また細胞の極性や形態変化を制御する細胞内因子をコードする遺伝子が多数発見された。これとは別に,私たちは細胞外マトリックスの主要成分であるプロテオグリカンの糖鎖合成あるいは糖鎖修飾に関与するいくつかの遺伝子が神経管やそれに隣接する脊索で特異的に発現することを発見した。本研究ではこれらの遺伝子の機能解析を行い,神経管形成における細胞運動制御のメカニズム解明を目指す。特に,細胞膜上の受容体や接着分子などを介して,細胞外のシグナルと細胞内の因子との相互作用がいかにして行われているかを解明したい。
藤原 滋樹(ふじわら しげき)
学歴・職歴
1987(昭和62)年 京都大学理学部卒業(生物学)
1989(平成元)年 京都大学大学院理学研究科修士課程修了(動物学)
1989(平成元)年 京都大学大学院理学研究科博士後期課程入学(動物学)
1990(平成2)年 京都大学大学院理学研究科退学-高知大学理学部生物学教室助手
1997(平成9)~1998(平成10)年 カリフォルニア大学バークレー校研究員
1999(平成11)年 高知大学理学部物質科学科助教授
2006(平成18)年 高知大学理学部物質科学科教授
2008(平成20)年 高知大学教育研究部自然科学系(理学部門)教授
2010(平成22)年 高知大学総合研究センター(海洋生物学部門)兼任教授
現在に至る
代表論文
1) Epidermal expression of Hox1 is directly activated by retinoic acid in the Ciona intestinalis embryo.
Kanda M, Wada H, Fujiwara S.
Dev Biol. 2009 Nov 15; 335(2): 454-63. Epub 2009 Sep 25.? PMID: 19782671
2) Nodal regulates neural tube formation in the Ciona intestinalis embryo.
Mita K, Fujiwara S.
Dev Genes Evol. 2007 Aug; 217(8): 593-601. Epub 2007 Jul 12.? PMID: 17624550
3) Retinoids and nonvertebrate chordate development.
Fujiwara S.
J Neurobiol. 2006 Jun; 66(7): 645-52. Review.? PMID: 16688759
|
|
|
「原生動物の耐性シスト形成を誘導するシグナル伝達系の解明」
松岡 達臣(自然科学系理学部門動物生理学研究室 教授)
研究の概要
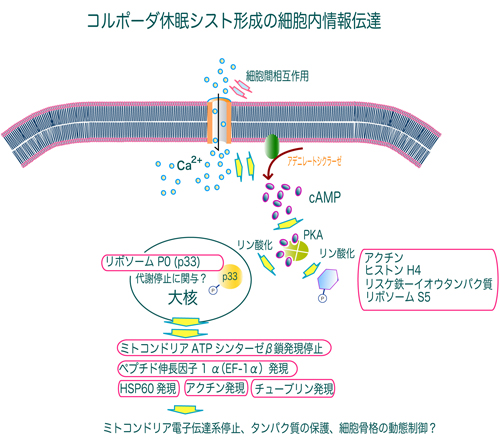
原生動物の耐性休眠シスト形成と脱シスト(発芽)の分子機構の解明は、「細胞構造の構築機構の解明」という細胞生物学的な意義だけでなく、耐性シストを形成する病原性原生動物による感染症の治療を視野にいれた基盤研究としても重要です。私たちは、土壌性原生動物であるコルポーダ(Colpoda cucullus)の耐性休眠シスト形成と脱シストの細胞内情報伝達機構の解明を目指して研究を進めてきました。この結果、シスト形成の情報伝達系がカルシウムイオンによって活性化されること、その経路の下流においてcAMP/タンパクキナーゼA(PKA)依存的にアクチンやリボソームS5タンパク質などのリン酸化レベルの上昇がおきることなどを発見しました。さらに、タンパク質のリン酸化に続いて、ATPシンターゼβ鎖、ヒートショックタンパク質などの複数のタンパク質の発現レベルが大きく変化することも明らかになってきました。これらの結果から、病原性の有無に関係なく原生動物の種を超えた共通のシスト形成のしくみが存在することが推察されます。現在は、Feeding RNAiノックダウン法を用いて、これらのタンパク質の発現を抑制することにより、シスト形成における機能解明を目指しています。
松岡 達臣(まつおか たつおみ)
学歴
1979年 高知大学文理学部卒業
1985年 広島大学大学院理学研究科博士課程単位取得退学
1986年 理学博士(筑波大学)
職歴
1986年 アルバートアインシュタイン医科大学研究員
1988年 高知大学理学部助手
1992年 同助教授
1999年 同教授
受賞
2000年 日本原生動物学会賞
代表論文
1) Blepharismin 1-5, novel photoreceptor from the unicellular organism Blepharisma japonicum.
Maeda M, Naoki H, Matsuoka T, Kato Y, Kotsuki H, Utsumi K, Tanaka T.
Tetrahedron Lett. 1997, 38: 7411-7414
2) Protein phosphorylation in encystment-induced Colpoda cucullus: Localization and identification of phosphoproteins.
Sogame Y, Kojima K, Takeshita T, Fujiwara S, Miyata S, Kinoshita E, Matsuoka T.
FEMS Microbiol. Lett. 2012, 331: 128-135.
3) EF-1a and mitochondrial ATP synthase b chain: alteration of their expression in encystment-induced Colpoda cucullus.
Sogame Y., Kojima K., Takeshita T., Kinoshita E., Matsuoka T.
J. Euk. Microbiol. 2012, 59: 401-406
|
|
|
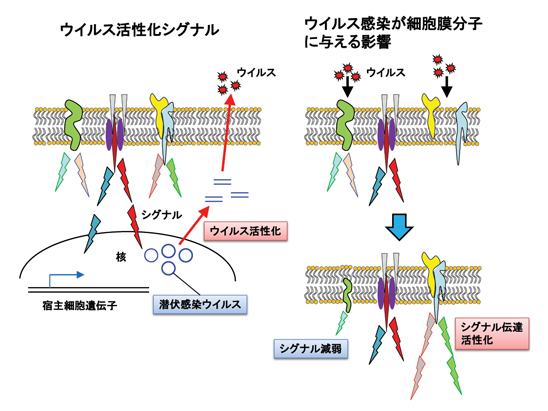
「感染ウイルス遺伝子を発現変化させる細胞膜分子とそのシグナル伝達の解明」
大畑 雅典 (医療学系基礎医学部門微生物学講座 教授)
研究概要
ヘルペスウイルスに代表されるように、ある種のウイルスは感染後潜伏感染あるいは持続感染の状態で長く体内に留まり、時に様々な刺激によって再活性化を起こす。その「潜伏感染」と「再活性化」のメカニズムを解明することは、感染症制御の観点からも極めて重要である。一方、腫瘍ウイルスでもあるEBウイルス(EBV)などは、宿主細胞膜上に自らの蛋白を発現させ、それにより細胞増殖をもたらすシグナル伝達を生み出している。
本プロジェクトでは、EBVを中心として、ウイルス再活性化に寄与する細胞膜上のシグナル分子の探究、および細胞膜から核内遺伝子発現へと至るシグナル伝達機構の解明を目指す。さらに微生物感染が細胞膜上のどのような分子に影響を与えるのかを明らかにしたい。
大畑 雅典(だいばた まさのり)
学歴・職歴
1985年 高知医科大学(現高知大学医学部)卒業
1989年 高知医科大学大学院博士課程修了(医学博士)
1989~1994年 米国マサチューセッツ医科大学 Instructor
1994~2000年 高知医科大学文部教官助手(第三内科)
2000~2003年 高知医科大学 血液・呼吸器内科(第三内科)講師
2003~2007年 高知大学医学部 血液・呼吸器内科(第三内科)講師
2007~2009年 高知大学医学部 血液・呼吸器内科(第三内科)准教授
2009年~ 高知大学医学部 微生物学講座 教授 現在に至る
学会資格
日本内科学会認定総合内科専門医・指導医
日本血液学会認定血液専門医・指導医
日本感染症学会認定感染症専門医
日本呼吸器学会認定呼吸器専門医
ICD制度協議会インフェクションコントロールドクター
日本がん治療認定医機構 がん治療認定医
受賞
2000年 日本癌学会 奨励賞
代表論文
1) Hashida Y, Imajoh M, Nemoto Y, Kamioka M, Taniguchi A, Taguchi T, Kume M, Orihashi K, Daibata M. Detection of Merkel cell polyomavirus with a tumour-specific signature in non-small-cell lung cancer. Br J Cancer. 108: 629-637, 2013.
2) Daibata M, Nemoto Y, Bandobashi K, Kotani N, Kuroda M, Tsuchiya M, Okuda H, Takakuwa T, Imai S, Shuin T, Taguchi H. Promoter hypermethylation of the bone morphogenetic protein-6 gene in malignant lymphoma. Clin Cancer Res. 13: 3528-3535, 2007.
3) Daibata M, Bandobashi K, Kuroda M, Imai S, Miyoshi I, Taguchi H. Induction of lytic Epstein-Barr virus (EBV) infection by synergistic action of rituximab and dexamethasone renders EBV-positive lymphoma cells more susceptible to ganciclovir cytotoxicity in vitro and in vivo. J Virol. 79: 5875-5879, 2005.
4) Daibata M, Taguchi T, Nemoto Y, Taguchi H, Miyoshi I. Inheritance of chromosomally integrated human herpesvirus 6 DNA. Blood. 94: 1545-1549, 1999.
5) Daibata M, Taguchi T, Sawada T, Taguchi T, Miyoshi I. Chromosomal transmission of human herpesvirus 6 DNA in acute lymphoblastic leukaemia. Lancet. 352: 543-544, 1998.
|
|
|
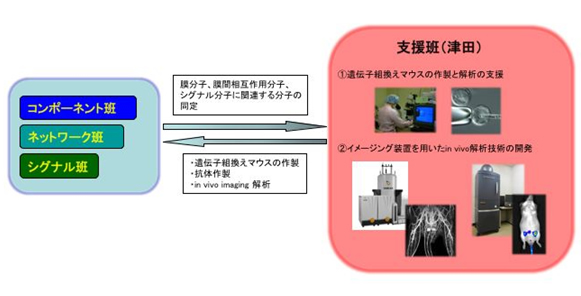
「①遺伝子組換えマウスの作製と解析の支援
②イメージング装置(MRI、蛍光イメージング)を用いたin vivo解析技術の開発」
津田 雅之(総合研究センター生命・機能物質部門動物資源開発分野 准教授)
研究の概要
①遺伝子組換えマウスの作製と解析の支援
現在、生命科学の分野では遺伝子組換えマウスを用いたin vivoでの解析が必要不可欠である。動物資源開発分野では、各研究班が解析している分子や新規分子に関連する抗体や遺伝組換えマウスの作製を行っている。また、膜間相互作用やシグナル伝達に関与する分子の動態や相互作用を生体内で可視化できるような遺伝子を組換えマウスを作製するなど、新しいツールの開発も行っている。
②イメージング装置(MRI、蛍光イメージング)を用いたin vivo解析技術の開発
さまざま実験動物用のイメージング装置が開発され、生きたままの動物を非侵襲的に観察できるようになってきた。動物実験施設には、蛍光イメージング装置や高磁場MRIが導入され、生体内における分子の分布・動態を解析することが可能となった。動物資源開発分野ではこれらの装置を用いて、生体膜機能の解明につなげるとともに、新しいイメージング技術の開発を行っている。
津田 雅之(つだ まさゆき)
学歴・職歴
| 2000.5 |
大阪大学大学院医学研究科博士課程 修了 |
| 2000.6 |
リサーチアソシエイト(筑波大学生物科学系) |
| |
国立医薬品食品衛生研究所 毒性部 |
| 2001.4 |
科学技術振興事業団(CREST)研究員 |
| |
国立遺伝学研究所 発生工学研究室 |
| 2005.4 |
獨協医科大学・生理学(生体情報)助教 |
| 2008.6 |
高知大学 総合研究センター 生命・機能物質部門 |
| |
動物資源開発分野 准教授 |
代表論文
1) Tsuda M, Sasaoka Y, Kiso M, Abe K, Haraguchi S, Kobayashi S, Saga Y: Conserved role of nanos proteins in germ cell development. Science. 2003 Aug 29;301(5637):1239-41
2) Tsuda M, Kiso M, Saga Y: Implication of nanos2-3’UTR in the expression and function of nanos2. Mech Dev. 2006 Jun;123(6):440-9
3) Suzuki A*, Tsuda M*, Saga Y: Functional redundancy among Nanos proteins and a distinct role of Nanos2 during male germ cell development. Development. 2007 Jan;134(1):77-83 (* equal contribution)
|
|

















![]() MAIL
MAIL















