トップページ > 研 究
研 究
当講座では、「試験管内に終わらず、臨床応用できる研究」をモットーに、主に泌尿器科癌の研究に取り組んでいます。主な研究テーマは、以下の通りであり、医局内でのリサーチミーティングや国内外での学会および論文にて、その成果を発表しています。
現在、先端医療学コース・光線医療班で、池本龍樹さん、西胤瑛純さん、山口頌太さん、石川真紀子さんが研究を行っています。


受賞歴
龍治修一 第16回 KMS Research Meeting 2017年2月23日
「ヒト前立腺癌細胞株を用いたphotodynamic therapyの検討」
「特別賞(医学科同窓会賞)」受賞
中山孟士 第17回 KMS Research Meeting 2018年2月15日
「光線力学治療の臨床応用を目指して ~膀胱癌における試み~」
「奨励賞」受賞
光力学班
光力学技術に基づく癌の診断や治療に関する研究
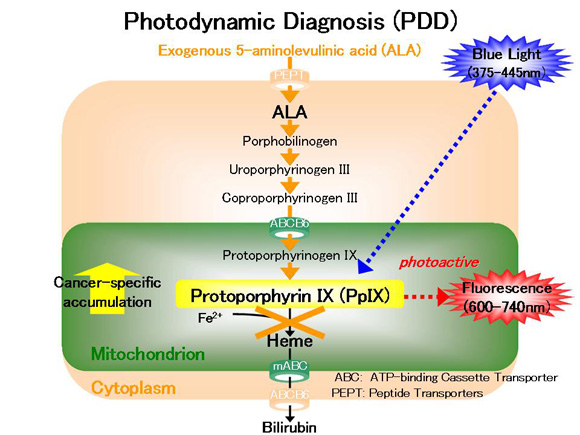
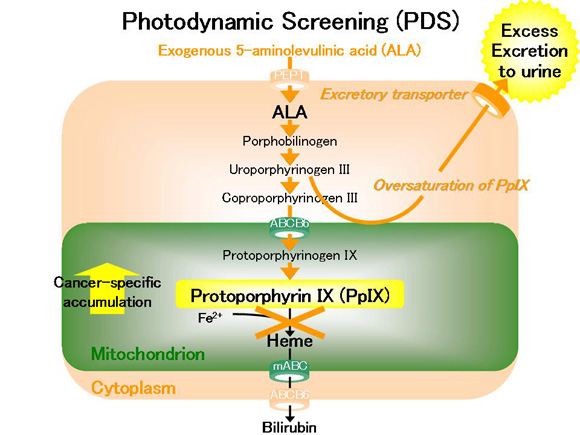
新世代の光感受性物質である5-アミノレブリン酸 (5-aminolevulinic acid (ALA))を用いた光力学技術は癌の有する共通の生物学的特性を根幹とした技術であり、その安全性および有効性より、多くの癌腫に対する診断や治療における新しい戦略として、まさに今、実臨床に導入されつつあります。
光力学班は、このALAを用いた光力学技術に基づく癌の診断や治療に関する基礎研究から臨床研究、さらにはその技術開発に取り組み、さらに東京工業大学や高知工科大学などとも共同研究を行っています。
ALA投与後に特定波長の可視光線の励起光を照射することにて、癌において蛍光を発光させ診断する光力学診断 (photodynamic diagnosis (PDD))、癌において細胞傷害性活性酸素種 (reactive oxygen species (ROS))を発生させ治療する光力学治療 (photodynamic therapy (PDT))、さらには、ALA投与後に血中や尿中のポルフィリン物質を測定することにて、癌をスクリーニングする光力学スクリーニング (photodynamic screening (PDS))の3技術がテーマとなります。
※画像クリックで拡大します
癌生物学班
尿路移行上皮癌を対象とした、血管新生に基づく浸潤、転移機構の解明および分子標的治療
泌尿生殖器癌を含めた固形腫瘍は、限局性である限り多くの場合、外科的切除にて根治が可能です。ひき続き起こる浸潤や転移こそが人を死に至らしめる直接の原因と考えられます。
近年、この浸潤・転移に関して、様々な促進因子や抑制因子の解明がなされていますが、個々の因子だけでは浸潤・転移のメカニズムを説明するのは困難です。我々はこれら因子のバランスやその発現時期が浸潤・転移の重要なポイントと考えてます。
また、癌の転移には臓器親和性がみられ、"Seed and Soil説"(Paget, 1889年)つまり癌細胞(Seed)そのものの性質に加え、標的臓器における接着、細胞外基質分解、走化・運動、増殖、血管新生などに関わる微小環境(Soil)も重要と考えます。
分子生物学班
VHL癌抑制タンパクの機能に関する研究
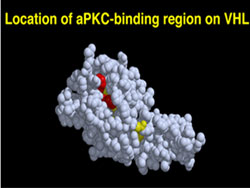
VHL癌抑制遺伝子はVHL病のみならず散発性腎癌においても高頻度で変異が認められることから、腎癌発症メカニズムへの関与が推定されているが、その遺伝子産物であるVHLタンパクの機能についての十分な解明はなされていない。近年、VHLタンパクがユビキチン=プロテアソーム系におけるユビキチンリガーゼとして作用することが明らかにされ、その標的タンパクとして低酸素状態で作用する遺伝子転写調節因子(HIF)が同定され血管新生因子の発現制御への関与が報告された。
しかし、血管新生の亢進だけでは初期の腎癌発症機構を説明することは困難であり、VHLタンパクにはHIF以外にも標的タンパクが存在すると考えられている。
当研究室ではVHLタンパクの新規標的タンパクとして細胞内シグナル伝達分子であるatypical Protein Kinase C (aPKC)がユビキチン化され分解されることをこれまでに明らかにしている。aPKCは上皮細胞の極性決定に重要な役割を持つタンパクであることから、現在、VHLの異常によるaPKC分解制御の乱れと細胞癌化の関係について解析を進めている。
腎細胞癌における遺伝子発現の網羅的解析研究
Clear cell typeの散発性腎癌では、VHL癌抑制遺伝子の異常が高頻度で認められるが、このとき癌細胞全体としてどのような遺伝子群に発現の変動が生じているかは明らかではない。そこでVHL遺伝子欠損の癌細胞株と野生型あるいは変異型VHL遺伝子を発現させた細胞株を材料として、マイクロアレイ解析を用いての網羅的遺伝子発現解析を行っている。
これにより腎細胞の癌化に関与する遺伝子群の同定が進めば発症メカニズムの理解がより進むものと期待される。今後はLaser capture microdissection (LCM)を用いて癌細胞を組織中より選択的に採取して得られるRNAを用いることで前立腺癌等の遺伝子発現解析にも対応していく。
腎癌における遺伝子メチル化に関する研究
細胞癌化の過程で癌抑制遺伝子が変異や欠失により不活化されることは従来より知られているが、近年遺伝子のプロモーター領域のメチル化によっても遺伝子の発現が抑制されることが明らかになってきた。
消化器系癌等ではメチル化によって発現が抑制される複数の癌関連遺伝子が同定されているが、腎癌のメチル化による遺伝子発現制御については不明の点が多い。
そこで、腎癌由来細胞株および腎癌腫瘍組織由来DNAを材料として、腫瘍組織特異的にメチル化している遺伝子のクローニングを行うことで、腎癌発症機構に関与する癌関連遺伝子の同定ならびに腫瘍マーカーとして使用可能な遺伝子の探索を試みている。
VHL, MET, BHD, FH遺伝子を対象とした腎癌の遺伝子診断
家族性腫瘍であるVon Hippel-Lindau (VHL) 病の原因遺伝子であり、散発性腎癌でも高頻度で異常の認められるVHL癌抑制遺伝子の他、近年腎癌の新たな原因遺伝子として報告されたBHD遺伝子、FH遺伝子などについても遺伝子診断を実用化し、これらの遺伝子の異常と腎癌発症メカニズムの関連についての研究を行っている。
遺伝子解析班
前立腺癌における責任遺伝子の網羅的解析研究
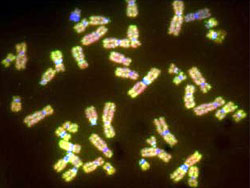
現在、前立腺癌の治療法は、主として根治的前立腺全摘術、放射線療法、ホルモン療法が行われており、一定の効果は認められている。しかしながら、なぜ前立腺癌が起こるのか、あるいは進行、再発の機序はいまだに明らかになっていないのが現状であり、これらの問題解決の糸口として染色体、遺伝子の解析が重要となっている。 われわれは、これまでに、第一解剖学教室,田口尚弘講師とともに、蛍光インサイチュハイブリダイゼーション(FISH)法、comparative genomic hybridization (CGH) 法を用いて、前立腺癌関連遺伝子が存在する領域の特定を行っている。
今後は、FISH法、CGH法での経験を活かし、Laser capture microdissection (LCM)、マイクロアレイ解析など新しい技術を積極的に取り入れ、前立腺癌に対する新規薬剤開発など臨床応用可能な責任遺伝子の特定を解明するべく、研究に取り組んでいる。